薬剤師国家試験 平成27年度 第100回 - 一般 理論問題 - 問 91
分子間相互作用に関する記述のうち、正しいのはどれか。2つ選べ。
1 酸素原子の電気陰性度は硫黄原子より大きいため、分子間に働く水素結合はH2Oの方がH2Sよりも強い。
2 静電的相互作用によるポテンシャルエネルギーは、距離の2乗に反比例する。
3 分散力は、ロンドン力とも呼ばれ、そのポテンシャルエネルギーは距離の4乗に反比例する。
4 ファンデルワールス相互作用は、分子間の距離により引力として働く場合と斥力として働く場合がある。
5 疎水性相互作用はファンデルワールス相互作用により説明される。
 REC講師による詳細解説! 解説を表示
REC講師による詳細解説! 解説を表示
-
解答 1、4
1 正
電気陰性度とは、結合に使われている電子対を引き寄せる力の度合いであり、原子半径が小さいほど、また有効核荷電(原子核の正電荷+内殻の電子の負電荷)が大きいほど電気陰性度は大きい。電気陰性度の大きい原子が水素原子と結合していると、水素結合は強い正の電荷を帯びる。この正の電荷を帯びた水素原子と、他のローンペアを持つ原子との間で電気的に引き合う結合を水素結合という。このため、酸素原子の電気陰性度は硫黄原子より大きいため、分子間に働く水素結合はH2Oの方がH2Sよりも強い。
2 誤
静電的相互作用によるポテンシャルエネルギーUは、次の式により表すことができる。

上記の式より、静電的相互作用によるポテンシャルエネルギーは距離に反比例する。
3 誤
分散力は、ロンドン力とも呼ばれ、そのポテンシャルエネルギーは距離の6乗に反比例する。
4 正
ファンデルワールス相互作用とは、電荷のない中性分子又は原子間に働く引力又は斥力のことであり、中性分子又は原子間の距離が遠い場合は引力として働き、近い場合は斥力(反発力)として働く。
5 誤
疎水性相互作用とは、水中に存在する無機性物質(疎水物質)が水を避けて会合する際にみられる相互作用のことである。(下図参照)
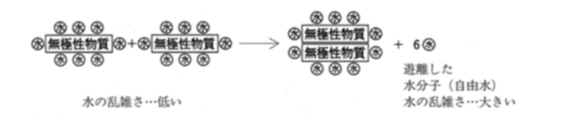
水中では、無機性物質(疎水物質)が集合することにより、遊離した水分子(自由水)が増加するため、安定な状態となる。このことから、疎水性相互作用は水のエントロピーの増大により説明される。
- この過去問解説ページの評価をお願いします!
-
評価を投稿
 REC講師による詳細解説! 解説を表示
REC講師による詳細解説! 解説を表示


