薬剤師国家試験 平成27年度 第100回 - 一般 理論問題 - 問 93
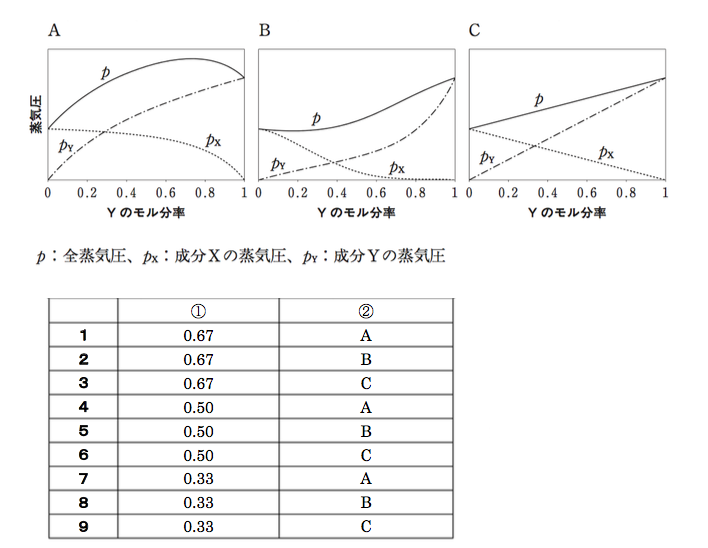
次の文章の に入る数値及び記号の正しい組み合わせはどれか。1つ選べ。 ① となる。ただし、成分XとYの蒸気圧をそれぞれ500 hPa、1000 hPaとする。また、成分X、Yが理想溶液とみなせず、XとYの分子間相互作用が同種分子間の相互作用よりも弱い場合の圧力は ② のようなグラフになる。
解説を表示
※1 より以下のように求めることができる。※2 より、蒸気分圧から、各成分のモル分率を以下のように求めることができる。
解説動画1 ( 11:28 )
※ この解説動画は 60 秒まで再生可能です
再生速度
通常速度
1.1 倍速
1.2 倍速
1.3 倍速
1.4 倍速
1.5 倍速
1.6 倍速
1.7 倍速
1.8 倍速
1.9 倍速
2.0 倍速
この過去問解説ページの評価をお願いします!
評価を投稿
 REC講師による詳細解説! 解説を表示
REC講師による詳細解説! 解説を表示 解説動画1 ( 11:28 )
解説動画1 ( 11:28 )

