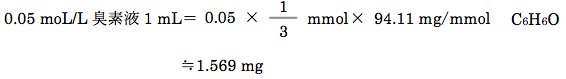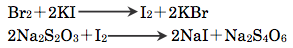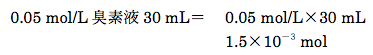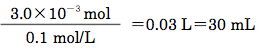薬剤師国家試験 平成29年度 第102回 - 一般 理論問題 - 問 96
日本薬局方フェノール(C6H6O:94.11)の定量法に関する記述のうち、正しいのはどれか。2つ選べ。
本品約1.5 gを精密に量り、水に溶かし正確に1000 mLとし、この液25 mLを正確に量り、ヨウ素瓶に入れ、正確に0.05 moL/L臭素液30 mLを加え、更に塩酸5 mLを加え、直ちに密栓して30分間しばしば振り混ぜ、15分間放置する。次に A 7 mLを加え、直ちに密栓してよく振り混ぜ、クロロホルム1 mLを加え、密栓して激しく振り混ぜ、遊離したヨウ素を0.1 mol/Lチオ硫酸ナトリウム液で滴定する(指示薬:デンプン試液1 mL)。同様の方法で空試験を行う。
0.05 moL/L臭素液1 mL= B mg C6H6O
1 A に入る試液は、ヨウ化カリウム試液である。
2 B の対応量は、4.705である。
3 下線においてクロロホルムを加える理由は、沈殿した2,4,6−トリブロモフェノールを溶解させるためである。
4 臭素液のf=1.000の場合、空試験の0.1 mol/Lチオ硫酸ナトリウム液の理論量は15.0 mLである。
5 試料を約1.5 g量るとは、1.30 gから1.70 gの範囲内で秤量することである。
 REC講師による詳細解説! 解説を表示
REC講師による詳細解説! 解説を表示
-
解答 1、3
本法は、酸化還元滴定によってフェノールの定量を行っている。本操作は試料溶液に過剰の臭素を加えて、フェノールと臭素を反応させた後、未反応の臭素に対してヨウ化カリウムを加え、反応させることで遊離したヨウ素をチオ硫酸ナトリウム液で滴定を行う逆滴定である。
1 正
上記参照。
2 誤
臭素はフェノール性水酸基のo、p位と反応し、2,4,6−トリブロモフェノールが生成される。
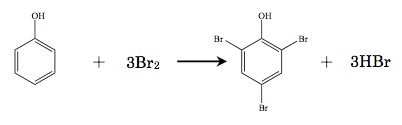
よって、1 molのフェノールは3 molの臭素と反応するため、0.05 moL/L臭素液1 mL(0.05mmol/mL 臭素)と反応するフェノールは0.05 mmol×1/3となる。
フェノールの分子量が94.11であることから、0.05 moL/L臭素液1 mLと反応するフェノールの量は下記のように計算される。
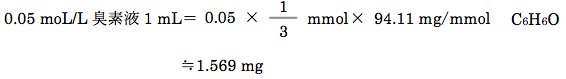
よって、対応量は1.569 mgである。
3 正
本定量は、臭素とフェノールが反応し、2,4,6−トリブロモフェノールが沈殿物として生成する反応を利用して定量を行っている。沈殿した2,4,6−トリブロモフェノールにより溶液が白濁し、滴定の終点が不鮮明になるため、クロロホルムを加えて、2,4,6−トリブロモフェノールを溶解する必要がある。
4 誤
空試験とは医薬品を加えずに本試験と同様の操作を行う方法である。本定量における空試験は、医薬品であるフェノールを加えていないため、標準液の0.05 mol/L臭素液30 mLは反応せずに残っている。そこにヨウ化カリウムを加えてできた生成物に0.1 mol/Lチオ硫酸ナトリウムで滴定すると、以下の反応が起こる。
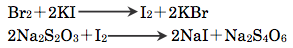
反応式より臭素1 molに対してチオ硫酸ナトリウムは2 mol消費されることがわかる。
また、0.05 mol/L臭素液(f=1.000)30 mL中の臭素の物質量は下記のように計算される。
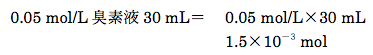
よって、本滴定に必要な0.1 mol/Lチオ硫酸ナトリウムの物質量は1.5×10-3 mol×2=3.0×10-3 molとなる。
これを0.1 mol/Lチオ硫酸ナトリウムの溶液量(mL)で表すと下記のように計算される。
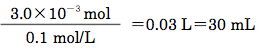
したがって、空試験の0.1 mol/Lチオ硫酸ナトリウム液の理論量は30 mLとなる。
5 誤
日本薬局方通則において、定量に供する試料の採取量に「約」を付けたものは、記載された量の±10%の範囲をいうと規定されている。よって約1.5 g量るとは、1.35 g〜1.65 gの範囲内で秤量することである。
-
 解説動画1 ( 18:56 )
解説動画1 ( 18:56 )
-
※ この解説動画は 60 秒まで再生可能です
|
再生速度
|
|
- この過去問解説ページの評価をお願いします!
-
評価を投稿
 REC講師による詳細解説! 解説を表示
REC講師による詳細解説! 解説を表示 解説動画1 ( 18:56 )
解説動画1 ( 18:56 )