薬剤師国家試験 平成31年度 第104回 - 一般 理論問題 - 問 170
25℃において固相が十分に存在する条件下、pHと弱電解質Aの分子形とイオン形の溶解平衡時の濃度の関係を図に表した。以下の記述のうち、正しいのはどれか。2つ選べ。ただし、弱電解質Aの分子形とイオン形の溶解平衡時の濃度比はHenderson−Hasselbalchの式に従い、弱電解質Aの溶解やpH調整に伴う容積変化は無視できるものとする。必要ならば、log2=0.30、log3=0.48、101/2=3.2を用いて計算せよ。
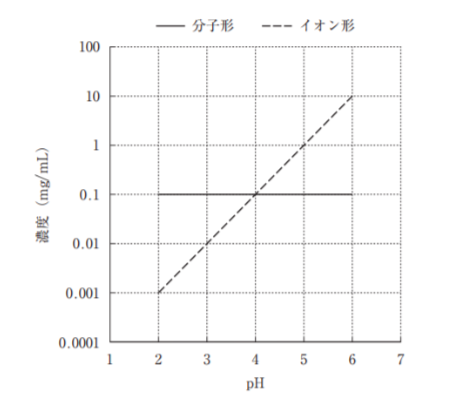
1 弱電解質Aは弱酸性化合物である。
2 弱電解質AのpKaは2.0である。
3 25℃において、pH7.0のときの弱電解質Aの溶解度は、pH6.0のときの溶解度の約10倍になると予想される。
4 25℃において、pH1.0のときの弱電解質Aの溶解度は、pH2.0のときの溶解度の約1/10倍になると予想される。
5 25℃において、弱電解質A 5 mgを水1 mLに分散させたとき、pH5.5以上になると全量が溶解すると予想される。
 REC講師による詳細解説! 解説を表示
REC講師による詳細解説! 解説を表示
-
解答 1、3
設問中の図は、固相が十分に存在する条件下において、弱電解質Aの分子形とイオン形の溶解平衡時の濃度の関係を示している。グラフの縦軸である濃度は、各pHにおける分子形とイオン形の溶解度と一致している。
1 正
イオン形のグラフより、pH増加に伴いイオン形の溶解度が増加していることがわかる。したがって、弱電解質Aは弱酸性化合物であると判断できる。
2 誤
pKaとは分子形とイオン形が等モル濃度存在している時の溶液のpHに等しいため、設問中の図の分子形とイオン形の直線の交点(分子形とイオン形が等モル濃度存在)におけるpHがpKaとなる。したがって、弱電解質AのpKaは4.0である。
3 正
弱酸性薬物の溶解度(Cs)は①式で表すことができる。
Cs=[Cs分]+[Csイ]=[Cs分]・(1+10pH−pKa)…①
・pH=7.0のときの溶解度Csは
Cs=0.1 mg/mL×(1+107.0−4.0)=100.1 mg/mL
・pH=6.0のときの溶解度Csは
Cs=0.1 mg/mL×(1+106.0−4.0)=10.1 mg/mL
したがって、pH7.0のときの溶解度CsはpH6.0のときの溶解度Csの約10倍である。
4 誤
・pH=1.0のときの溶解度Csは
Cs=0.1 mg/mL×(1+101.0−4.0)=0.1001 mg/mL
・pH=2.0のときの溶解度Csは
Cs=0.1 mg/mL×(1+102.0−4.0)=0.101 mg/mL
したがって、pH1.0のときの溶解度CsはpH2.0のときの溶解度Csとほぼ等しい。
5 誤
・pH=5.5のときの溶解度Csは
Cs=0.1 mg/mL×(1+105.5−4.0)
=0.1 mg/mL×(1+101.5)
=0.1 mg/mL×(1+10×101/2)
=0.1 mg/mL×(1+10×3.2)
=0.1 mg/mL×33
=3.3 mg/mL
したがって、pH5.5のとき弱電解質Aは水1 mLに3.3 mgまでしか溶解できない(全量5mg溶解しない)。
-
 解説動画1 ( 18:47 )
解説動画1 ( 18:47 )
-
※ この解説動画は 60 秒まで再生可能です
|
再生速度
|
|
- この過去問解説ページの評価をお願いします!
-
評価を投稿

 REC講師による詳細解説! 解説を表示
REC講師による詳細解説! 解説を表示 解説動画1 ( 18:47 )
解説動画1 ( 18:47 )

