薬剤師国家試験 令和03年度 第106回 - 一般 理論問題 - 問 92
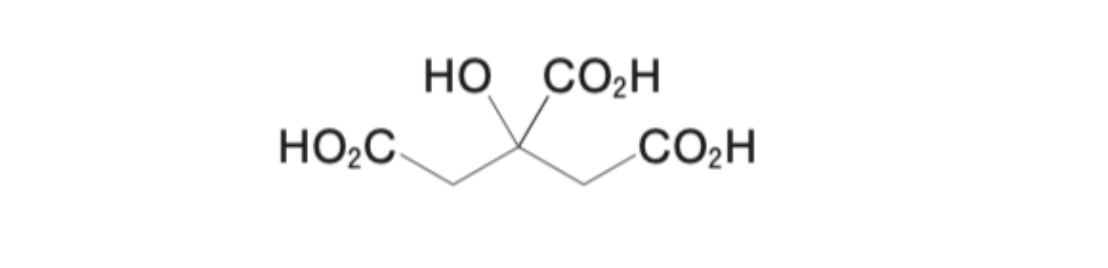
前問で調製した1 mol/L水酸化ナトリウム液を標定した結果、ファクターは、1.025であった。日本薬局方無水クエン酸(C6H8O7:192.12、下図)適量を水50 mLに溶かし、この標準液を用いて滴定した結果、滴定量は7.85 mLであった(指示薬:フェノールフタレイン試液1滴)。この時、無水クエン酸の量(mg)はいくらか。1つ選べ。
1 4.905 × 102
2 5.03 × 102
3 5.15 × 102
4 1.51 × 103
5 1.545 × 103
 REC講師による詳細解説! 解説を表示
REC講師による詳細解説! 解説を表示
-
解答 3
日本薬局方無水クエン酸の定量法である中和滴定に関する問題である。
無水クエン酸は3つのカルボキシ基を有するため、無水クエン酸と水酸化ナトリウムは1:3のモル比で反応する。
無水クエン酸と反応した水酸化ナトリウムの量(mmol)は、濃度が1 mol/L、ファクターが1.025、滴定量が7.85 mLより、1 mol/L × 1.025 × 7.85 mL ≒ 8.046 mmolと計算できる。
よって、無水クエン酸の量をX mmolとすると、X mmol:8.046 mmol = 1:3の関係が成り立つため、X=2.682 mmolとなる。
無水クエン酸の分子量は192.12なので、求める無水クエン酸の量(mg)は、2.682 mmol × 192.12 g/mol ≒ 515 mg = 5.15 × 102 mgとなる。
-
 解説動画1 ( 07:52 )
解説動画1 ( 07:52 )
-
※ この解説動画は 60 秒まで再生可能です
|
再生速度
|
|
- この過去問解説ページの評価をお願いします!
-
評価を投稿

 REC講師による詳細解説! 解説を表示
REC講師による詳細解説! 解説を表示 解説動画1 ( 07:52 )
解説動画1 ( 07:52 )

