薬剤師国家試験 令和03年度 第106回 - 一般 理論問題 - 問 98
生体における化学反応は約37℃で進行するが、化学反応は温度の影響をうけるため熱力学パラメーターの温度依存性を知ることは重要なことである。圧力一定条件下での温度Tと熱力学パラメータ(ΔrG○、ΔrH○、TΔrS○)の関係が図のようになる化学反応に関する記述のうち、正しいのはどれか。2つ選べ。ただし、ΔrG○、ΔrH○、ΔrS○は、それぞれ標準反応ギブズエネルギー、標準反応エンタルピー、標準反応エントロピーを表す。
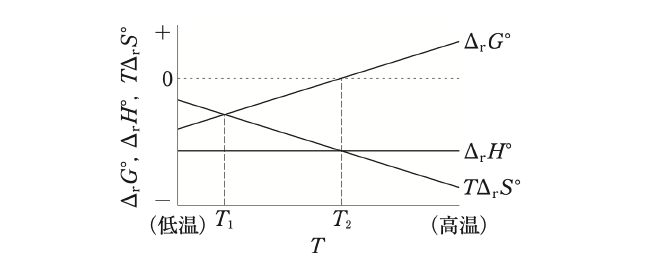
1 この化学反応は、発熱反応である。
2 温度T1での平衡定数は、温度T2での平衡定数よりも小さい。
3 温度がT2より高温側での平衡定数は、1より小さい。
4 温度がT2より低温側では、この反応はエントロピー駆動となる。
5 温度がT2よりも低温側では、反応の進む向きは反応物と生成物の初期濃度に依存しない。
 REC講師による詳細解説! 解説を表示
REC講師による詳細解説! 解説を表示
-
解答 1、3
1 正
エンタルピー変化量が負の値となる反応は発熱反応、正の値となる反応は吸熱反応である。本化学反応は、温度によらずΔrH○<0であることから、発熱反応である。
2 誤
平衡定数Kと標準反応ギブズエネルギーΔrG○には以下の関係が成り立つ。
ΔrG○=-RT lnK(R:気体定数(R>0)、T:絶対温度(T>0))
温度T1における平衡定数をK1とすると、ΔrG○<0であるため、lnK1>0となる。
自然対数の底eは1より大きい数なので、K1>e0=1より、K1>1となる。
温度T2における平衡定数をK2とすると、ΔrG○=0であるため、lnK2=0より、K2=1となる。
よって、K1>K2となるため、温度T1での平衡定数は、温度T2での平衡定数よりも大きい。
3 正
温度がT2より高温側における平衡定数をK3とすると、ΔrG○>0であるため、lnK3<0となる。
自然対数の底eは1より大きい数なので、K3<e0=1より、K3<1となる。
よって、温度がT2より高温側での平衡定数は、1より小さい。
4 誤
ΔrG○、ΔrH○、ΔrS○は絶対温度Tを用いて以下の関係が成り立つ。
ΔrG○=ΔrH○-TΔrS○
温度がT2より低温側では、常にΔrG○<0が成り立つため、本化学反応は自発的に進行する。自発変化が起きる際、ΔrH○が負の値をとることでΔrG○<0となる自発反応をエンタルピー駆動の反応といい、ΔrS○(TΔrS○)が正の値をとることでΔrG○<0となる自発反応をエントロピー駆動の反応という。本反応は、ΔrH○が負の値をとるため、エンタルピー駆動の反応である。
5 誤
一般的に反応の進む向きは反応物と生成物の初期濃度に依存する。
平衡定数Kは、[平衡状態における生成物の濃度の積]/[平衡状態における反応物の濃度の積]の形で与えられる定数である。化学反応は、[生成物の濃度の積]/[反応物の濃度の積]の値が平衡定数Kに近づく方向に向かって進行するため、反応物の初期濃度が極端に多い場合は反応が右に進み、生成物の初期濃度が極端に多い場合は反応が左に進むと考えられる。
-
 解説動画1 ( 17:13 )
解説動画1 ( 17:13 )
-
※ この解説動画は 60 秒まで再生可能です
|
再生速度
|
|
- この過去問解説ページの評価をお願いします!
-
評価を投稿

 REC講師による詳細解説! 解説を表示
REC講師による詳細解説! 解説を表示 解説動画1 ( 17:13 )
解説動画1 ( 17:13 )

