薬剤師国家試験 令和05年度 第108回 - 一般 理論問題 - 問 93
酸化還元反応と化学電池に関する記述のうち、正しいのはどれか。2つ選べ。
1 酸化還元反応において、電子を受け取るのは還元剤である。
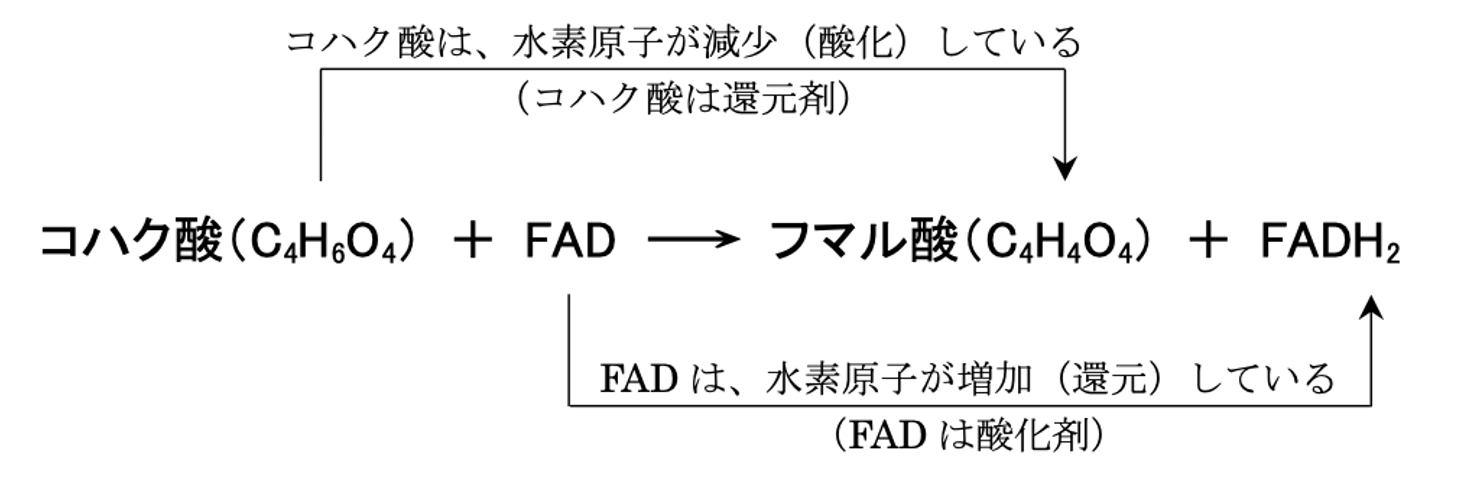
2 コハク酸(C4H6O4)+ FAD → フマル酸(C4H4O4)+ FADH2の反応において、コハク酸は酸化剤である。
3 進行中の酸化還元反応の起電力は、Henderson−Hasselbalchの式で表すことができる。
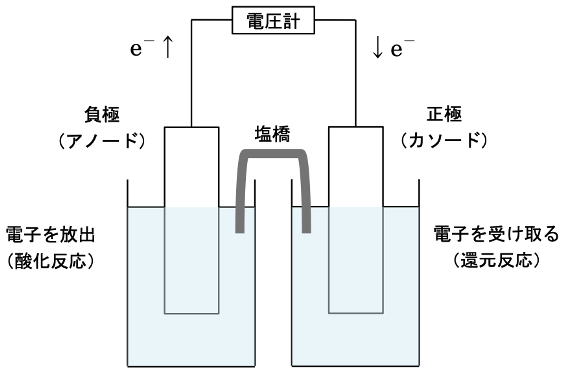
4 電解質の濃度のみが異なる2つの半電池からなる化学電池(濃淡電池)の標準起電力は0 Vである。
5 反応が自発的に進行している化学電池では、カソード(正極)で還元反応が起こる。
 REC講師による詳細解説! 解説を表示
REC講師による詳細解説! 解説を表示
-
 解説動画1 ( 15:50 )
解説動画1 ( 15:50 )
- ※ この解説動画は 60 秒まで再生可能です
|
ビデオコントロール | |
|
|
| 再生速度 |
- この過去問解説ページの評価をお願いします!
-
- わかりにくい
- とてもわかりやすかった