薬剤師国家試験 平成28年度 第101回 - 一般 理論問題 - 問 98
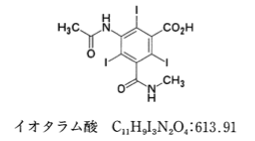
次の記述は日本薬局方イオタラム酸の定量法に関するものである。
「本品を乾燥し、その約0.4 gを精密に量り、けん化フラスコに入れ、水酸化ナトリウム試液40 mLに溶かし、亜鉛粉末1 gを加え、還流冷却器を付けて30分間煮沸し、冷後、ろ過する。フラスコ及びろ紙を水50 mLで洗い、洗液は先のろ液に合わせる。この液に酢酸(100)5 mLを加え、0.1 mol/L硝酸銀液で滴定する(指示薬:テトラブロモフェノールフタレインエチルエステル試液1 mL)。ただし、滴定の終点は沈殿の黄色が緑色に変わるときとする。」
本品0.4500 gをとり、上記の定量法に従って、0.1 mol/L硝酸銀液(f=1.000)で滴定したところ、18.00 mLを消費した。このときイオタラム酸の含量%に最も近い数値を1つ選べ。
1 75.0
2 81.9
3 88.8
4 95.5
5 99.5
 REC講師による詳細解説! 解説を表示
REC講師による詳細解説! 解説を表示
-
解答 2
日本薬局方イオタラム酸の定量法に関する問題である。
本定量法は、イオタラム酸を水酸化ナトリウム試液に溶かし、亜鉛粉末を加え還元的に分解することにより生じるヨウ化物イオンを硝酸銀液で滴定する方法である。
本品を水酸化ナトリウム試液に溶かし、亜鉛粉末を加え還元的に分解すると、1 molのイオタラム酸より、3 molのヨウ化物イオンが遊離する。その後、0.1 mol/L硝酸銀液で滴定すると、ヨウ化物イオンと銀イオンが1:1で反応し、ヨウ化銀となり沈殿する。
これらのことから、イオタラム酸の対応数(医薬品1molと反応する標準液のmol数)は3となるため、対応量(標準液1 mLに対する医薬品の量)を以下のように求めることができる。
対応量=標準液の濃度×医薬品の分子量÷対応数
0.1 mol/L硝酸銀液1 mL=0.1 mol/L×613.91 g/mol÷3=20.46 mg イオタラム酸
本問では、「本品0.4500 gをとり、上記の定量法に従って、0.1 mol/L硝酸銀液(f=1.000)で滴定したところ、18.00 mLを消費した。」となっていることから、本品に含まれるイオタラム酸の量及び含量(%)を以下のように求めることができる。
本品に含まれるイオタラム酸の量=対応量×消費量×f=20.46 mg/mL×18.00 mL×1.000=368.28 mg
含量(%)=本品に含まれるイオタラム酸の量÷本品の秤取量×100=368.28 mg÷0.4500 g×100=368.28 mg÷450 mg×100=81.84(%)
- この過去問解説ページの評価をお願いします!
-
評価を投稿

 REC講師による詳細解説! 解説を表示
REC講師による詳細解説! 解説を表示
