薬剤師国家試験 令和04年度 第107回 - 一般 理論問題 - 問 94
生体膜の膜電位は、膜の両側におけるイオン濃度の不均衡によって生じる。そのイオン濃度の不均衡は、生体膜が水や小さいイオンは通すが、大きなイオンは通さない半透膜の性質をもつことで生じる。
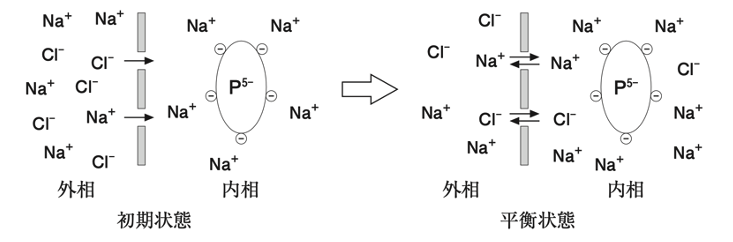
図のように、半透膜の内相にタンパク質P5-(-5の電荷をもち5Na+が対イオンとなっている)の0.01 mol/L水溶液を置き、外相には濃度が0.1 mol/LのNaCl水溶液を置いておく。平衡状態に達したとき、半透膜の外相と内相のNa+とCl-の濃度には次式が成立している。
[Na+]外相・[Cl-]外相 = [Na+]内相・[Cl-]内相
平衡に達したときの半透膜の内相と外相のNa+濃度の差に最も近い値はどれか。1つ選べ。ただし、浸透圧差に基づく物質の移動は考慮しないものとする。
1 0.01 mol/L
2 0.03 mol/L
3 0.05 mol/L
4 0.07 mol/L
5 0.09 mol/L
 REC講師による詳細解説! 解説を表示
REC講師による詳細解説! 解説を表示
-
解答 2
(初期状態の各イオンの濃度)
半透膜の外相は、濃度が0.1 mol/LのNaCl水溶液であるため、半透膜の外相のNa+濃度、Cl-濃度ともに0.1 mol/Lとなる。
半透膜の内相は、濃度が0.01 mol/Lのタンパク質P5-水溶液であり、タンパク質P5-は5Na+が対イオンとなっているため、半透膜の内相のNa+濃度は、0.01 mol/L×5=0.05 mol/Lとなる。また、半透膜の内相にCl-は存在しないため、半透膜の内相のCl-濃度は0 mol/Lとなる。
(平衡状態到達時の各イオンの濃度)
初期状態から平衡に達した際のNa+の濃度変化をX(mol/L)とおくと、電気的中性の原理により、Cl-の濃度変化もX(mol/L)となるため、平衡状態に達したときの半透膜の外相と内相のNa+とCl-の濃度は以下の通りである。
[Na+]外相:0.1-X mol/L、[Cl-]外相:0.1-X mol/L、[Na+]内相:0.05+X mol/L、[Cl-]内相:X mol/L
問題文より、 [Na+]外相・[Cl-]外相 = [Na+]内相・[Cl-]内相 が成り立つため、
(0.1-X)・(0.1-X)=(0.05+X)・X
上式より、X=0.04 mol/Lとなる。
したがって、平衡に達したときの半透膜の内相と外相のNa+濃度の差は、
[Na+]内相 -[Na+]外相=0.09-0.06=0.03 mol/Lとなる。
-
 解説動画1 ( 12:25 )
解説動画1 ( 12:25 )
-
※ この解説動画は 60 秒まで再生可能です
|
再生速度
|
|
- この過去問解説ページの評価をお願いします!
-
評価を投稿

 REC講師による詳細解説! 解説を表示
REC講師による詳細解説! 解説を表示 解説動画1 ( 12:25 )
解説動画1 ( 12:25 )

