薬剤師国家試験 令和03年度 第106回 - 一般 理論問題 - 問 99
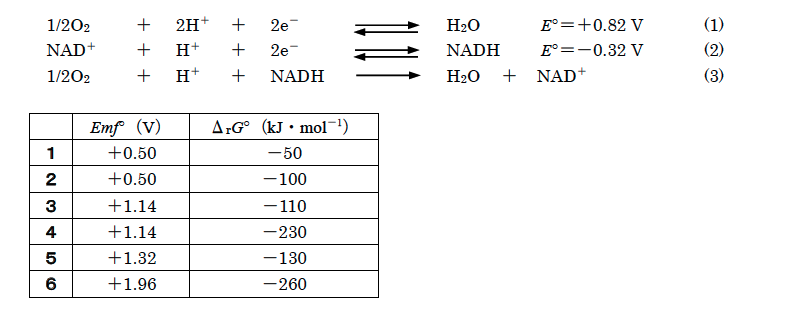
呼吸鎖において2つの電子が移動して酸素から水が生成する反応は、次の二つの半反応(1)、(2)を組み合せた酸化還元反応(3)と考えることができる(E○はpH7、25℃における標準電位)。この反応のpH7、25℃における標準起電力Emf○と標準反応ギブズエネルギーΔrG○の値の組合せとして正しいのはどれか。1つ選べ。ただし、ファラデー定数は1.0×105 C・mol-1の近似値を用いることとする。
 REC講師による詳細解説! 解説を表示
REC講師による詳細解説! 解説を表示
-
解答 4
酸化還元反応の標準起電力Emf○は、2つの半電池の標準電位の差で求めることができる。標準起電力は正の値で示されるため、標準起電力Emf○は以下の式で表すことができる。
Emf○=(+0.82)-(-0.32)=+1.14 V
また、標準反応ギブズエネルギーΔrG○は、ΔrG○=−nFEmf○で表すことができる。ただし、Fはファラデー定数、nは関与する電子の化学量論係数を表す。
設問の反応では、2e-が反応に使われており、電子の化学量論係数はn=2である。
したがって、ΔrG○=-nFEmf○より、ΔrG○は以下で表すことができる。
ΔrG○=-2×(1.0×105 C・mol-1)×1.14 V
=-2×(1.0×105 C・mol-1)×1.14 J・C-1
=-2.28×105 J・mol-1
≒-230 kJ・mol-1
-
 解説動画1 ( 07:45 )
解説動画1 ( 07:45 )
-
※ この解説動画は 60 秒まで再生可能です
|
再生速度
|
|
- この過去問解説ページの評価をお願いします!
-
評価を投稿

 REC講師による詳細解説! 解説を表示
REC講師による詳細解説! 解説を表示 解説動画1 ( 07:45 )
解説動画1 ( 07:45 )

