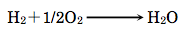薬剤師国家試験 平成26年度 第99回 - 一般 理論問題 - 問 92
1×105 N/m2、107℃で水素1.0 molと酸素0.50 molを反応させ、水(気体)を合成した。この反応に伴い243 kJの熱が発生した。水素と酸素はすべて反応し、温度及び圧力は一定であった。この反応に伴う内部エネルギー変化(kJ)に最も近いのはどれか。1つ選べ。ただし、気体定数R=8.31(J mol-1 K-1)とする。
1 -360
2 -240
3 -120
4 120
5 240
6 360
 REC講師による詳細解説! 解説を表示
REC講師による詳細解説! 解説を表示
-
解答 2
内部エネルギーの変化ΔUは以下の式で表すことができる。
ΔU=q+w ……① (q:熱、w:仕事)
仕事が体積変化により起こると考えると、①式を次のように変換することができる。
ΔU=q-pΔV ……② (p:圧力、V:体積)
また、完全気体(理想気体)の状態方程式は以下のように表される。
pV=nRT ……③(n:気体分子の物質量、R:気体定数、T:絶対温度)
②、③式より、④式を導くことができる。
ΔU=q-ΔnRT ……④
水素1.0 molと酸素0.50 mol(合計1.5 mol)を反応させると、水(気体)1.0 molが合成されるためΔn=-0.50 molとなる。
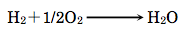
また、この反応に伴い243 kJの熱が発生している。
これらのことから、④式を用いて内部エネルギーの変化を以下のように求めることがでできる。
ΔU=q-ΔnRT=-243 kJ-{(-0.5 mol)×8.3 J mol-1 K-1×(107+273)K}
=-243 kJ+1578.9 J
=-243 kJ+1.5789 kJ
≒-241 kJ
-
 解説動画1 ( 17:18 )
解説動画1 ( 17:18 )
-
※ この解説動画は 60 秒まで再生可能です
|
再生速度
|
|
- この過去問解説ページの評価をお願いします!
-
評価を投稿
 REC講師による詳細解説! 解説を表示
REC講師による詳細解説! 解説を表示 解説動画1 ( 17:18 )
解説動画1 ( 17:18 )